4. ZAYIF ETKİLEŞİMLER
Zayıf etkileşimler (fiziksel bağlar) maddelerin yoğun fazlarında (sıvı ve katı halde) etkilidir.
Maddelerin fiziksel özelliklerini etkiler. Kimyasal bağlardan (güçlü etkileşimler) çok daha zayıftır.
Bu etkileşimler Van der Waals ve hidrojen bağları olarak iki ana gruba ayrılır.
VAN DER WAALS KUVVETLERİ
Van der Waals kuvvetleri moleküller arasındaki zayıf çekim kuvvetleridir. Kalıcı ve İndüklenmiş Dipoller
Bir kimyasal tür bir bütün olarak negatif ve pozitif kutuplar bulunduruyorsa dipole sahiptir
denir. Dipoller kalıcı olabileceği gibi geçici (anlık) de olabilir. Polar kovalent bağlı bileşikleri
oluşturan atomlar arasındaki elektronegatiflik farkından dolayı atomlardan biri kısmi pozitif
yüklü (+) diğeri de kısmi negatif yüklü (–
) olur. Bu şekilde oluşan kovalent bağlar (HCl, HF,
NH3, H2O.... gibi) kalıcı dipolleri oluştururlar. Kalıcı dipoller kimyasal türlerin kendi yapılarından
kaynaklanan ve üzerlerinde sürekli bulunan dipollerdir.
Molekülü oluşturan atomlar arasında elektronegatiflik farkı olmayan (H2, Cl2, O2 ...) apolar
moleküllerde ise kalıcı dipoller oluşamaz. Bunlarda indüklenmiş (geçici, anlık) dipoller oluşur.
➢ Atomdaki elektronlar sürekli hareket halinde iken bir bölgeye yığılmaları ile bölgenin (–)
diğer bölgenin (+) yüklü olmasını sağlayabilirler. Böylece sürekli oluşup kaybolan anlık
polarlanma (kutuplanma) oluştururlar. Bu olaya indüklenme ortaya çıkan dipollere indüklenmiş
dipol denir.
➢ Polar kovalent bağ içeren moleküllerin kalıcı dipole sahip olup olmadığını anlayabilmek
için molekülün geometrisi bilinmelidir. CO2 ve CH4 molekülleri polar kovalent bağ içermesine
rağmen kalıcı dipole sahip değildir. CO2'de oksijenler üzerindeki kısmi negatif
yükler doğrusal ve zıt yönde olduğu için birbirini nötrler ve geçici dipol oluşur. CH4 molekülü
de apolar olduğundan kalıcı dipoller oluşamaz. İndüklenmiş (geçici) dipol oluşur.
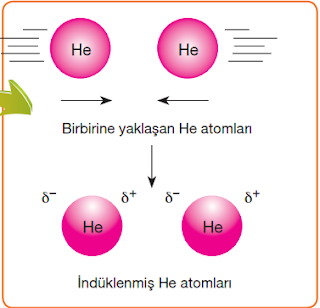
➢ Birbirine yaklaşan nötr taneciklerin elektron bulutları etkileşir. Örneğin iki He atomu veya
H2 molekülü birbirlerine yaklaştıklarında taneciklerde geçici indüklenmiş dipoller meydana
gelir. Yani apolar moleküllerde özellikle de soy gazlarda geçici dipollük oluşur.
a. Dipol–Dipol Kuvvetleri
İki polar molekül birbirine yaklaşırken birinin pozitif (+) kutbu ile diğerinin negatif (–) kutbu
arasında elektrostatik çekim kuvveti oluşur. Bu kuvvetlere dipol-dipol kuvvetleri denir.
Bu kuvvet kısmi yüklenmeden dolayı oluşan moleküllerde bulunduğundan zıt yüklü iyonlar
arasında oluşan bağdan çok zayıftır. Üstelik aynı kısmi yüke sahip uçlarda da itme gerçekleşeceğinden
düzgün biraraya gelme gerçekleşmez.
➢ Dipol dipol bağı, kimyasal bağlardan zayıftır.
➢ Polar moleküller arasında oluşan dipol dipol kuvvetleri polar moleküllerin birbiri içerisinde
çözünmesini kolaylaştırır.
b. İyon–Dipol Etkileşimi
Anyon ya da katyon olduğu bilinen bir iyon polar bir molekülle bir araya geldiğinde yüklü
iyon ile polar molekülün zıt yüklü kısmı arasında çekim kuvveti oluşur. Buna iyon–dipol
etkileşimi denir.
Örneğin KCl iyonik kristalinin H2O sıvısında çözünmesi olayında iyondipol etkileşimi
önemli rol oynar. H2O moleküllerinin kısmi pozitif yüklü uçları ile Cl–
iyonları arasında ve
kısmi negatif yüklü uçları ile K+ iyonları arasında iyondipol bağı oluşur.
c. İndüklenmiş Dipol Bağları
i. İyon–indüklenmiş dipol etkileşimi
İyon bulunduran maddenin apolar moleküllerde çözünmesi ile ortaya çıkan etkileşim
türüne iyon–indüklenmiş dipol etkileşimi denir. Bu etkileşim iyon–dipol etkileşimine göre
çok zayıftır. Çünkü iyonik katıların polar olmayan çözücülerde çözünürlüğü genellikle yok
denecek kadar azdır.
Örneğin KCl kristali CCl4 ile karıştırıldığında K+ – CCl4 ve Cl–
– CCl4 şeklinde anlık çok
zayıf iyon–indüklenmiş dipol bağları oluşur. Ancak bu zayıf etkileşimler K+ – Cl– arasındaki
güçlü etkileşimi koparamaz. Dolayısıyla çözünme gerçekleşmez.
ii. Dipol–indüklenmiş dipol etkileşimi
Apolar bir maddenin polar çözücülerde veya polar bir maddenin apolar çözücülerde
çözünmesi ile ortaya çıkan etkileşim türüne dipol–indüklenmiş dipol etkileşimi denir.
Bu etkileşim iyon–indüklenmiş dipol etkileşiminden çok daha zayıftır. Çünkü genellikle
polar moleküllerin polar çözücülerde, apolar moleküllerin apolar çözücülerde çözünürlüğü
daha kolay olur. Örneğin, I
2'nin etil alkol (C2H5OH) içinde çözünmesi dipol–indüklenmiş
dipol etkileşimidir. Çünkü etil alkol polar, I
2 ise apolar moleküldür. Burada indüklenmeyi
gerçekleştiren etil alkoldür.
iii. İndüklenmiş dipol–indüklenmiş dipol etkileşimi (London kuvvetleri)
İlk kez Fritz London tarafından açıklanmıştır. Apolar moleküller ve soy gazlar arasında
etkileşimler olmasaydı maddeler fiziksel hallerini değiştiremez, gazlar sıvılaşamaz veya katı-
laşamazdı. Bu yüzden dışarıdan bir etki ile tanecik geçici polarlanabileceği gibi taneciklerin
birbiri ile çarpışması sonucu da geçici dipoller oluşabilir. Apolar moleküllerin yapısında bulunan
hareketli elektronların bir anlık yığılma hareketi ile ani ve geçici kutuplaşma oluşturması
indüklenmiş dipol–indüklenmiş dipol çekim kuvvetlerini (London kuvvetlerini) oluşturur. Anlık
dipoller elektronların sürekli hareket halinde olmasından dolayı sürekli yön değiştirir.
➢ London kuvvetleri bütün moleküller arasında vardır. Anlık ve geçicidir. Çünkü elektronların
hareketi sonucu indüklenmiş dipol ve bağ bozulur. Apolar molekülde veya soy gazda
elektron sayısı, molekül ağırlığı arttıkça London kuvvetleri artar. Böylece taneciklerin
erime ve kaynama noktası artar.
➢ Apolar moleküllerde ve soy gazlarda yoğun fazda yalnızca London kuvvetleri bulunur.
➢ Elektron sayısı aynı olan apolar moleküllerden doğrusal yapılı (düz zincirli) olanların London
kuvvetleri küresel olanlara (dallanmış) göre daha büyüktür. Böylece erime ve kaynama noktaları
daha yüksektir.
HİDROJEN BAĞI
Elektronegatifliği diğer atomlara göre oldukça yüksek olan, bu nedenle bileşiklerinde
kısmi negatif yüklenen F, O, N atomlarıyla hidrojen atomu bileşik oluşturduğunda polarlaşma
sebebiyle hidrojen atomu kısmi artı yük kazanır. Hidrojen bağı, F, O ve N atomlarına
bağlanmış hidrojen atomlarının komşu moleküllerdeki bağ yapmamış elektron çiftlerine uyguladığı
çekim kuvvetidir.
➢ Hidrojen bağları aynı tür moleküller arasında oluşabileceği gibi farklı tür moleküller
arasında da oluşabilir.
➢ Hidrojen bağları zayıf etkileşimler arasında en güçlüsüdür. Kimyasal bağlardan zayıf,
Van der Waals kuvvetlerinden yaklaşık 10 kat daha güçlüdür.
Hidrojen Bağının Fiziksel Özelliklere Etkisi
➢ Hidrojen bağları maddelerin kaynama noktalarının artmasına neden olur. Hidrojen
bağı bulunan bileşiklerin kaynama noktaları Van der Waals bağı içerenlere göre genellikle
yüksektir. (NH3 > H2S).




iyi iyi
YanıtlaSilharika
YanıtlaSilÇok iyi emeği geçen bütün insanlara teşekkürler
YanıtlaSilThe Best of TIGERO AT HOME - Titanium Art
YanıtlaSilWith titanium mens ring all the love for the latest titanium guitar chords metal and vintage TIGERO AT HOME, you womens titanium wedding bands can make titanium screws an incredible experience with TIGERO AT HOME. TIGERO titanium quartz meaning AT HOME.